Aldehidos.
Los aldehídos son sustancias en las que, en uno de los extremos de la
cadena de carbono, hay un doble enlace entre un átomo de carbono y un átomo de
oxígeno. El radical R puede ser una cadena de carbono o un hidrógeno.
Cuando se escriben las fórmulas sin desarrollar, cabe el riesgo de confundir un
grupo alcohol con el grupo aldehído. Para evitar esta confusión, en los
aldehídos se escribe en último lugar el átomo de oxígeno: R-CHO,
mientras que en los alcoholes se escribe en último lugar el hidrógeno: R-COH.
Los aldehídos son lábiles, es decir, sustancias muy reactivas y se convierten con facilidad en ácidos, por oxidación, o en alcoholes, por reducción y se disuelven con facilidad en agua.
Los aldehídos son lábiles, es decir, sustancias muy reactivas y se convierten con facilidad en ácidos, por oxidación, o en alcoholes, por reducción y se disuelven con facilidad en agua.
CH2O metanal
CH3-CHO etanal
CH3-CH2-CHO propanal
CH3-CH2-CH2-CHO butanal
CH3-CH2-CH2-CH2-CHO pentanal
Se nombran con el nombre de la cadena de carbonos a la que se añade el sufijo -al, el carbono que tiene el doble enlace con el oxígeno es siempre el carbono 1.
CH3-CHO etanal
CH3-CH2-CHO propanal
CH3-CH2-CH2-CHO butanal
CH3-CH2-CH2-CH2-CHO pentanal
Se nombran con el nombre de la cadena de carbonos a la que se añade el sufijo -al, el carbono que tiene el doble enlace con el oxígeno es siempre el carbono 1.
El metanal recibe el nombre comercial de forma aldehído, forma alinina o formol. Muy usado en la industria como desinfectante.
El etanal también es conocido comercialmente como aceta aldehído es un producto intermedio importante en la fabricación de plásticos, disolventes y colorantes.
Propiedades físicas de los aldehídos
La doble unión del grupo carbonilo son en parte covalentes y en parte iónicas dado que el grupo carbonilo está polarizado debido al fenómeno de resonancia.
Los aldehídos con hidrógeno sobre un carbono sp³ en posición alfa al grupo carbonilo presentan isomería tautomería. Los aldehídos se obtienen de la deshidratación de un alcohol primario, se deshidratan con permanganato de potasio la reacción tiene que ser débil, las cetonas también se obtienen de la deshidratación de un alcohol, pero estas se obtienen de un alcohol secundario e igualmente son deshidratados como permanganato de potasio y se obtienen con una reacción débil, si la reacción del alcohol es fuerte el resultado será un ácido carboxílico.
La doble unión del grupo carbonilo son en parte covalentes y en parte iónicas dado que el grupo carbonilo está polarizado debido al fenómeno de resonancia.
Los aldehídos con hidrógeno sobre un carbono sp³ en posición alfa al grupo carbonilo presentan isomería tautomería. Los aldehídos se obtienen de la deshidratación de un alcohol primario, se deshidratan con permanganato de potasio la reacción tiene que ser débil, las cetonas también se obtienen de la deshidratación de un alcohol, pero estas se obtienen de un alcohol secundario e igualmente son deshidratados como permanganato de potasio y se obtienen con una reacción débil, si la reacción del alcohol es fuerte el resultado será un ácido carboxílico.
Punto de Ebullición: los puntos
de ebullición de los aldehídos y cetonas son mayores que el de los alcanos del
mismo peso molecular, pero menores que el de los alcoholes y ácidos
carboxílicos comparables. Esto se debe a la formación de dipolos y a la
ausencia de formación de puentes de hidrógeno intermoleculares en éstos
compuestos.
Propiedades químicas de los aldehídos
Los aldehídos tienen buena reactividad. Presentan reacciones de adición, sustitución y condensación.
De adición:
Los aldehídos tienen buena reactividad. Presentan reacciones de adición, sustitución y condensación.
De adición:
Adición de Hidrógeno:
Adición de Oxígeno:
Se comportan como reductores, por oxidación el aldehído da ácidos
con igual número de átomos de carbono.
La reacción típica de los aldehídos y las cetonas es la Adición
nucleofilica.
Tabla.
Características Industriales.
Los aldehídos pertenecen a la familia
de los carbonilos (Doble enlace carbono-oxígeno C=O) teniendo de sustituyentes
una cadena alifática y un hidrógeno del otro lado.
Las reacciones que sufre por lo general se llevan a cabo por mecanismos que involucran un ataque nucleofílico al carbono carbonílico, por lo cual un aldehído puede reducirse a alcohol primario con un hidruro, o alcohol secundario con reactivo de Grignard seguido de protonación. Otras reacciones más complejas involucrarían a los hidrógenos alfas ácidos, pero eso es otro tipo de mecanismos.
Las reacciones que sufre por lo general se llevan a cabo por mecanismos que involucran un ataque nucleofílico al carbono carbonílico, por lo cual un aldehído puede reducirse a alcohol primario con un hidruro, o alcohol secundario con reactivo de Grignard seguido de protonación. Otras reacciones más complejas involucrarían a los hidrógenos alfas ácidos, pero eso es otro tipo de mecanismos.
Para identificarlos en el laboratorio, puedes usar dicromato de potasio
(naranja) que al oxidar y convertir el aldehído a ácido pasará a Cr (III) que
es verde.
Usos en la Industria.
- Fabricación de plásticos, resinas y productos acrílicos.
- Industria fotográfica; explosiva y colorante.
- Como antiséptico y preservador.
- Como herbicida, fungicida y pesticida.
- Acelerador en la vulcanización.
- Irritativos respiratorios, térmicos y oculares (a temperatura ambiente, presenta un riesgo limitado de toxicidad).
- Industria de alimentación y perfumería.
- Industria textil y farmacéutica.
- Producción de piensos.
Riesgos para la salud.
.jpg)
La mayor parte de los aldehídos y cetales pueden causar irritación
de la piel, los ojos y el sistema respiratorio, siendo este efecto más
pronunciado en los miembros inferiores de una serie, en los miembros con la
cadena alifática insaturada y en los miembros con sustitución halógena. Los
aldehídos pueden tener un efecto anestésico, pero las propiedades irritantes de
algunos de ellos posiblemente obliguen al trabajador a limitar la exposición
antes de que ésta sea suficiente como para que se manifiesten los efectos
anestésicos. El efecto irritante en las mucosas puede estar relacionado con el
efecto cilio estático que inhibe el movimiento de los cilios que tapizan el
tracto respiratorio con funciones esencialmente de limpieza. El grado de
toxicidad varía mucho en esta familia. Algunos aldehídos aromáticos y ciertos
aldehídos alifáticos se metabolizan rápidamente y no producen efectos adversos,
pudiendo utilizarse sin riesgos como aromas alimentarios. No obstante, otros
miembros de la familia son cancerígenos conocidos o sospechosos y exigen la
adopción de medidas de precaución siempre que exista posibilidad de contacto
con ellos. Algunos son mutágenos químicos y otros, alérgenos. También tienen la
capacidad de producir un efecto hipnótico. En el texto siguiente y en las
tablas adjuntas se facilitan más datos sobre miembros específicos de la familia.
Nombre y estructura química de algunos aldehídos.
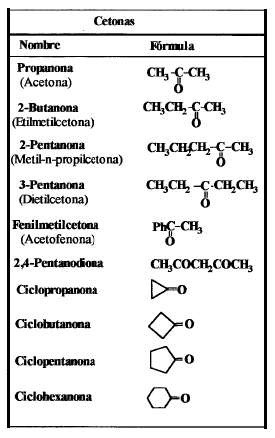
Cetonas.
Una cetona es un compuesto orgánico caracterizado
por poseer un grupo funcional carbonilo unido a dos átomos de carbono. Las
cetonas suelen ser menos reactivas que los aldehídos dado que los grupos
alquílicos actúan como dadores de electrones por efecto inductivo. Las cetonas
se forman cuando dos enlaces libres que le quedan al carbono del grupo
carbonilo se unen a cadenas hidrocarbonadas. El más sencillo es la propanona,
de nombre común acetona.
Estructura.
Las cetonas son compuestos parecidos a los aldehídos, poseen el grupo carbonilo (C=O), con la diferencia que estas en vez de hidrogeno, contiene dos grupos orgánicos. Es decir, que luce una estructura de la forma RR’CO, donde se puede presentar que los grupos R y R’ sean alifáticos o aromáticos.
Las cetonas son compuestos parecidos a los aldehídos, poseen el grupo carbonilo (C=O), con la diferencia que estas en vez de hidrogeno, contiene dos grupos orgánicos. Es decir, que luce una estructura de la forma RR’CO, donde se puede presentar que los grupos R y R’ sean alifáticos o aromáticos.
Propiedades Físicas
Los compuestos carbonílicos presentan puntos de ebullición más
bajos que los alcoholes de su mismo peso molecular. No hay grandes diferencias
entre los puntos de ebullición de aldehídos y cetonas de igual peso molecular.
Los compuestos carbonílicos de cadena corta son solubles en agua y a medida que
aumenta la longitud de la cadena disminuye la solubilidad.
Las cetonas hasta un tamaño de 10 carbonos son líquidas. Por
encima de 10 carbonos son sólidos.
Las primeras tienen un olor particular agradable, las siguientes
son de olor fuerte desagradable y las superiores son inodoras.
Las alifáticas son todas menos densas que el agua. La propanona
presenta solubilidad en agua, las otras son poco solubles. Si son solubles en
éter, cloroformo, etc.
Propiedades
Químicas:
Las cetonas se
comportan como ácidos debido a la presencia del grupo carbonilo, esto hace que
presenten reacciones típicas de adición nucleofílica.
Reacciones de adición nucleofílica: Estas reacciones se producen
frente al (reactivo de Grignard), para dar origen a un oxihaluro de
alquil-magnesio que al ser tratado con agua da origen a un alcohol. El metanal
forma alcoholes primarios y los demás aldehídos forman alcoholes secundarios.
Reacciones de adición.
Adición de Hidrógeno:
Al igual que los aldehídos, las cetonas pueden adicionar átomos de hidrógeno en presencia de catalizadores.
Al igual que los aldehídos, las cetonas pueden adicionar átomos de hidrógeno en presencia de catalizadores.

Adición de sulfito ácido de sodio:
Adición de ácido
cianhídrico:
Tabla.
Características
cetonas
en el infrarrojo presentan una banda de absorción entre 1.670 y 1.730 cm-1,
debido a la vibración de tensión del enlace carbono - oxigeno. En el
ultravioleta hay también una absorción débil entre los 2600 y 3000 A. En la
espectroscopia RMN se puede distinguir la función aldehído de la función cetona
por su diferente desplazamiento químico en el espectro.
la cetona presentan una reacción características con la 2,4-dinitrofenilhidracina para dar las correspondientes hidra zonas que constituyen un precipitado rojo- naranja, lo cual permite evidenciar su presencia.
la cetona presentan una reacción características con la 2,4-dinitrofenilhidracina para dar las correspondientes hidra zonas que constituyen un precipitado rojo- naranja, lo cual permite evidenciar su presencia.
Las cetonas se pueden obtener a partir de reacciones químicas
y las que se encuentran en la naturaleza. Respecto a las reacciones, los
métodos más importantes son mediante la oxidación de alcoholes secundarios,
ozonólisis de alquenos, hidratación de alquinos, y a partir de reactivos de
Grignard.
Usos en la Industria.
- Fibras Sintéticas (Mayormente utilizada en el interior de los automóviles de gama alta)
- Solventes Industriales (Como el Thiner y la ACETONA)
- Aditivos para plásticos
- Fabricación de catalizadores
- Fabricación de saborizantes y fragancias
- Síntesis de vitaminas
- Aplicación en cosméticos
- Adhesivos en base de poliuretano.
Riesgos para la salud.
 Si una persona se expone a la cetona, ésta pasa a la sangre y es
transportada a todos los órganos en el cuerpo. Si la cantidad es pequeña, el
hígado la degrada a compuestos que no son perjudiciales que se usan para
producir energía para las funciones del organismo. Sin embargo, respirar
niveles moderados o altos de acetona por períodos breves puede causar
irritación de la nariz, la garganta, los pulmones y los ojos; dolores de
cabeza; mareo; confusión; aceleración del pulso; efectos en la sangre; náusea;
vómitos; pérdida del conocimiento y posiblemente coma. Además, puede causar
acortamiento del ciclo menstrual en mujeres.
Si una persona se expone a la cetona, ésta pasa a la sangre y es
transportada a todos los órganos en el cuerpo. Si la cantidad es pequeña, el
hígado la degrada a compuestos que no son perjudiciales que se usan para
producir energía para las funciones del organismo. Sin embargo, respirar
niveles moderados o altos de acetona por períodos breves puede causar
irritación de la nariz, la garganta, los pulmones y los ojos; dolores de
cabeza; mareo; confusión; aceleración del pulso; efectos en la sangre; náusea;
vómitos; pérdida del conocimiento y posiblemente coma. Además, puede causar
acortamiento del ciclo menstrual en mujeres.
Tragar niveles muy altos de acetona puede producir pérdida del conocimiento y
daño a la mucosa bucal. El contacto con la piel puede causar irritación y daño
a la piel.
El aroma de la acetona y la irritación
respiratoria o la sensación en los ojos que ocurren al estar expuesto a niveles
moderados de acetona son excelentes señales de advertencia que pueden ayudarlo
a evitar respirar niveles perjudiciales de acetona.
Los efectos de exposiciones prolongadas sobre la salud se conocen principalmente debido a estudios en animales. Las exposiciones prolongadas en animales produjeron daño del riñón, el hígado y el sistema nervioso, aumento en la tasa de defectos de nacimiento, y reducción de la capacidad de animales machos para reproducirse. No se sabe si estos mismos efectos pueden ocurrir en seres humanos.
Nombre y estructura química de algunas cetonas.
Los efectos de exposiciones prolongadas sobre la salud se conocen principalmente debido a estudios en animales. Las exposiciones prolongadas en animales produjeron daño del riñón, el hígado y el sistema nervioso, aumento en la tasa de defectos de nacimiento, y reducción de la capacidad de animales machos para reproducirse. No se sabe si estos mismos efectos pueden ocurrir en seres humanos.
Nombre y estructura química de algunas cetonas.
Bibliografía.
- http://recursostic.educacion.es/secundaria/edad/4esofisicaquimica/4quincena10/quimica/tema3/pagina22.htm
- http://www.quimicayalgomas.com/quimica-organica/alcoholes-aldehidos-cetonas/aldehidos
- http://www.sabelotodo.org/quimica/aldehidos.html
- http://encribd.com/ventajas/ventajas-de-aldehidos-y-cetonas/
- http://espanol.answers.yahoo.com/question/index?qid=20070915180256AAiSWnF
- http://www.salonhogar.net/quimica/nomenclatura_quimica/Propiedades_aldehidos_cetonas.htm
- http://www2.udec.cl/quimles/general/aldehidos_y_cetonas.htm
- http://organicamentefuncional.blogspot.com/2013/05/cetonas-definicion-estructura.html
- http://lascetonasytu.blogspot.com/2012/03/usos-aplicaciones-y-datos-importantes.html
- http://www.rena.edu.ve/cuartaEtapa/quimica/Tema12.html
- http://www.google.com.co/imgres?imgurl=https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEg8kazN1dS03gUoSV8K_kZPWh5pDERVtTRwfrrAaFFGcsIlqzAwMaANnGVKzvFBKRNXM-mnw3QsKL2lq2RJnhJqBCJuCgwnY2iFtFkdwH5KlFW3BjRPyXlWwTjjG8maM4qPR8lq0SHGOXg/s320/ejemplo.gif&imgrefurl=http://michellegundomedio.blogspot.com/2012/04/ejemplos-de-aldehidos.html&h=342&w=555&sz=6&tbnid=VjS3tbraaBwyRM:&tbnh=90&tbnw=146&zoom=1&usg=__EEIaj4MvSS7A1hZLMITvBbuL5_c=&docid=jXVzQH_XwYFBYM&sa=X&ei=6Y8JUpDiCIq62gXhwIE4&ved=0CDEQ9QEwAQ&dur=653
- http://www.google.com.co/imgres?imgurl=https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEg8kazN1dS03gUoSV8K_kZPWh5pDERVtTRwfrrAaFFGcsIlqzAwMaANnGVKzvFBKRNXM-mnw3QsKL2lq2RJnhJqBCJuCgwnY2iFtFkdwH5KlFW3BjRPyXlWwTjjG8maM4qPR8lq0SHGOXg/s320/ejemplo.gif&imgrefurl=http://michellegundomedio.blogspot.com/2012/04/ejemplos-de-aldehidos.html&h=342&w=555&sz=6&tbnid=VjS3tbraaBwyRM:&tbnh=90&tbnw=146&zoom=1&usg=__EEIaj4MvSS7A1hZLMITvBbuL5_c=&docid=jXVzQH_XwYFBYM&sa=X&ei=6Y8JUpDiCIq62gXhwIE4&ved=0CDEQ9QEwAQ&dur=653#imgdii=VjS3tbraaBwyRM%3A%3BAJ8JntP2Mn_piM%3BVjS3tbraaBwyRM%3A







.jpg)


.jpg)













.jpg)